IPOPARATIROIDISMO
La scoperta dell’esistenza delle ghiandole paratiroidi, del loro ruolo fisiologico, della modalità di azione del loro prodotto di secrezione e dei disturbi che un’anomala produzione di Paratormone (PTH) poteva indurre nell’organismo umano, è evoluta negli ultimi 150 anni. La scoperta delle paratiroidi fu, come molte altre scoperte in medicina, un evento fortuito da parte dell’anatomo-istologo svedese Ivar Sandström nel 1877, ma ancora molti anni sarebbero passati per comprenderne il ruolo fisiologico.
L’ipoparatiroidismo (ipoPTH) è una malattia piuttosto rara causata da un deficit totale o parziale della secrezione di paratormone (PTH) da parte delle ghiandole paratiroidi (ipoPTH vero). Si caratterizza per la presenza di ipocalcemia e iperfosfatemia che si associano spesso a sintomi conclamati e talvolta latenti di aumentata eccitabilità neuromuscolare. Si differenzia dallo pseudoipoparatiroidismo (pseudoipoPTH), perché, in quest’ultima condizione è presente una resistenza degli organi bersaglio all’azione del PTH, che non solo è presente ma spesso si vede aumentato nel siero a causa della incrementata secrezione compensatoria dell’ormone stesso.
La forma più frequente di ipoparatiroidismo è quella iatrogena, da ricondurre cioè alla ischemia o alla rimozione accidentale delle paratiroidi negli interventi chirurgici di tiroidectomia. L’incidenza varia da casistica a casistica, in relazione all’esperienza del chirurgo e ad altri fattori relativi all’indicazione e all’estensione dell’intervento chirurgico.
Le condizioni più rischiose per l’integrità delle paratiroidi sono la tiroidectomia totale (in particolare gli interventi più demolitivi per neoplasie, con svuotamento linfonodale), l’exeresi paratiroidea per iperparatiroidismo, la tiroidectomia totale per morbo di Basedow (dovuta all’aumentata vascolarizzazione del parenchima). L’ipoparatiroidismo post-chirurgico può essere transitorio nel 4.9-7.3% dei casi, di questi almeno il 60% si risolve entro 4-6 settimane. L’ipoparatiroidismo diviene permanente nello 0.12-4.6% dei casi, ed è definito tale quando si protrae per oltre sei mesi dopo l’intervento chirurgico. Sempre maggiore attenzione viene posta alle complicanze croniche di questa condizione che si riflettono su un aumentato rischio di complicanze renali (nefrolitiasi, insufficienza renale), cardiache, crisi comiziali, irritabilità nero-muscolare, disturbi neuro-psichiatrici, infezioni, patologie oftalmiche, cutanee. La mortalità cardiovascolare non sarebbe aumentata nell’ipoparatiroidismo post-chirurgico, mentre aumenterebbe la morbilità per patologie cardiovascolari, in particolare per cardiopatia ischemica, cardiopatia dilatativa, e scompenso cardiaco.
La prevalenza dell’ipoparatiroidismo da causa non chirurgica è stata stimata intorno a 2.3/100.000. E’ riconducibile a:
- Distruzione delle paratiroidi da patologia Autoimmune, irradiazione del collo, infiltrazione metastatica o per m. sistemiche (sarcoidosi, amiloioidosi, talassemia, ecc)
- Disordini congeniti delle paratiroidi: Sindrome Di George, Ipoparatiroidismo X-Linked isolato, Sindrome di Kenny-Caffey , Neuropatia Mitocondriale
- Riduzione della funzione paratiroidea per difetto del gene del PTH, o per Mutazione del Calcium Sensing Receptor (CaSR) (per mutazione iperattivante del gene che codifica per il CaSR)
L’unica causa reversibile di ipoparatiroidismo è associata ad una marcata ipomagnesemia, nella quale il reintegro di magnesio può completamente correggere l’ipoparatiroidismo.
Il paratormone (PTH) è un ormone “calciotropo”, responsabile cioè del mantenimento del corretto livello ematico del calcio. La sua azione si esplica a vari livelli:
Rene: Aumenta l’escrezione urinaria di cAMP; Aumenta il riassorbimento del calcio a livello del tubulo distale; Riduce il riassorbimento tubulare del Fosforo (PO4); Aumenta l’attivita’ della Vitamina D (attraverso l’aumento della 1- α idrossilasi con formazione della vitamina D attiva).
Ossa: Aumenta il riassorbimento di calcio e fosforo dall’osso ai liquidi extracellulari.
Intestino: Agisce indirettamente aumentando l’assorbimento di calcio e fosforo attraverso la sintesi della Vitamina D.
La sua azione, diretta sull’osso e sul rene ed indiretta sull’intestino, consente la mobilizzazione del Ca++ nel fluido extracellulare mantenendo costanti i valori di calcio nel sangue.
La maggior parte delle manifestazioni cliniche dell’ipocalcemia sono la conseguenza dello stato di ipereccitabilià neuromuscolare da essa indotta, in quanto viene ridotta la differenza tra potenziale a riposo e potenziale soglia della membrana cellulare, viene ridotto l’inotropismo cardiaco e ridotte le resistenze vascolari periferiche.
Un’ipocalcemia stabile e presente da tempo, solitamente non si associa a manifestazioni cliniche importanti, mentre il rapido decremento dei valori plasmatici di calcio ionizzato, spesso determinato da cause favorenti (iperfosfatemia, alcalosi metabolica o respiratoria, ipomagnesiemia, gravidanza e allattamento) caratterizza la crisi ipocalcemica, la cui manifestazione più importante è la tetania.
La crisi tetanica è caratterizzata da:
- spasmi della muscolatura del volto e degli arti
- adduzione delle braccia al tronco, flessione dell’avambraccio sul braccio
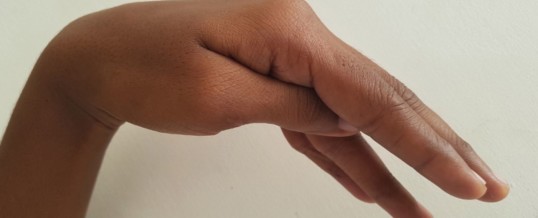
- spasmo carpo-pedale (flessione del gomito, polso e articolazioni metacarpo-falangee, estensione delle articolazioni inter-falangee ed adduzione del pollice – mano da ostetrico – con inarcamento della superficie plantare dei piedi)
- trisma – risus sardonicus
- opistotono
- faringospasmo, laringospasmo, broncospasmo
Le manifestazioni cliniche generalmente compaiono quando la calcemia totale scende sotto i 7-7.5 mg/dL e il calcio ionizzato è ≤ 1.15 mmol/L, ma esiste una forte variabilità individuale. Le manifestazioni più severe e che si manifestano con vari gradi di intensità sono:
- Sintomi neuromuscolari e neuromotori: Mialgie, crampi muscolari, spasmi muscolari: spasmo carpopedale, spasmo laringeo, smorfie del viso, Parestesie a mani e piedi.
Nelle forme più gravi si possono aver convulsioni, epilessia, sintomi extrapiramidali (parkinsonismo, emiballismo, distonie, coreoatetosi, crisi oculogire), papilledema. Nell’ipocalcemia sintomatica può essere evocato il segno di Chvostek (contrazione ipsilaterale di tutti o alcuni muscoli innervati dal nervo facciale con la deviazione laterale della rima labiale e della pinna nasale verso il lato stimolato) ed il segno di Trousseau (spasmo carpale provocato dall’ischemia dell’arteria radiale quando il bracciale di uno sfingomanometro viene applicato al braccio di un soggetto). Il segno di Trousseau viene ritenuto un indice più specifico di ipocalcemia rispetto il segno di Chvostek.
- Sintomi neurocognitive e neuropsichiatriche: difficoltà alla concentrazione e riduzione dell’acuità mentale “brain fog” (sensazione di cervello annebiato), somatizzazione, depressione, ansia, ostilità, ansia fobica e tendenza psicotica.
- Sintomi cardiovascolari: ipotensione, deficit di contrattilità miocardica con riduzione della gittata cardiaca, bradicardia, aritmie, diminuzione della sensibilità alla digitale, insufficienza cardiaca refrattaria, aumentata incidenza di eventi cardiovascolari (principalmente cardiopatia ischemica), senza peraltro incremento della mortalità cardiovascolare. La disfunzione cardiaca risponde brillantemente alla correzione dell’ipocalcemia, con risoluzione nel 98% dei pazienti.
- Manifestazioni renali: nefrolitiasi e nefrocalcinosi, con coliche renali ed IRC, sono complicanze dell’ipoparatiroidismo cronico, di lunga durata e mal controllato, per la necessità di supplementare calcio e vitamina D in una condizione nella quale c’è un ridotto riassorbimento di Calcio per la carenza appunto di PTH. La nefrolitiasi si riscontra nel 2-15% dei pazienti (frequenza quattro volte maggiore rispetto ai controlli); la nefrocalcinosi è particolarmente frequente nei casi di mutazione del recettore CaSR, per l’aumentata predisposizione ad espellere calcio per via renale. Complessivamente, predittori di ridotto VFG sono l’età del paziente, la durata di malattia, l’ipercalcemia relativa.
Nell’ipoparatiroidismo cronico possono determinarsi lesioni causate dalla deposizione di fosfato di calcio a livello dei tessuti, in particolare a livello cutaneo, del cristallino e nel sistema nervoso centrale.
- Manifestazioni cutanee
Circa il 50% dei pazienti ha pelle secca, desquamata e ruvida, secchezza e diradamento dei capelli del cuoio capelluto. Può essere presente una forma peculiare di dermatite, nota come impetigo erpetiforme nella quale i peli sono diradati al pube e alle ascelle, mentre le unghie sono fragili e deformate. Più raramente può essere presente psoriasi, dermatiti generalizzate esfoliative, ed una maggior predisposizione alle micosi.
- Manifestazioni oftalmiche
Cataratta: complicazione più frequente (cause non chiarite). La prevalenza va correlata all’età del paziente, alla durata e gravità dell’ipocalcemia. Coinvolge prevalentemente la parte corticale del cristallino (circa 80%).
Papilledema: cause non note si risolve con la correzione dell’ipocalcemia.
Rari casi di blefarospasmo, intensa fotofobia e cheratocongiuntivite cronica.
TERAPIA
Obiettivi fondamentali della terapia dell’ipoparatiroidismo debbono essere:
- migliorare i sintomi dell’ipocalcemia,
- mantenere la calcemia nei valori bassi della normalità,
- mantenere la fosforemia entro i limiti della norma,
- evitare l’ipercalciuria, mantenere un rapporto Ca/P (in mg/dl) < 55,
- evitare le calcificazioni ectopiche (soprattutto i danni renali),
- migliorare la qualità della vita
Nell’ipoparatiroidismo acuto l’obiettivo terapeutico primario è il controllo dei sintomi dell’ipocalcemia. La terapia dell’ipocalcemia acuta si basa sull’impiego di sali di calcio gluconato per uso endovenoso, (sono presenti circa 94 mg di calcio elementare per grammo di gluconato 9.4%) e di calcio cloruro che contiene 272 mg di calcio elementare per grammo di sale (27.2%). Quest’ultimo è meno usato per il suo effetto irritante e per il rischio di necrosi tessutale in caso di stravaso.
In pratica si somministrano 1-2 fiale di calcio gluconato da 1 g in 100 cc NaCl 0.9% o glucosata 5% in 2-5 min. La prima infusione di calcio consente solitamente di ottenere un aumento transitorio (circa 2 ore) del Ca++ ed è pertanto necessario instaurare una infusione continua ev di calcio gluconato. In caso di ipomagnesiemia, deve essere somministrato solfato di magnesio per via endovenosa
Nell’ipoparatiroidismo cronico la terapia si basa sull’utilizzo di sali di calcio (in aggiunta all’apporto alimentare) e calcitriolo. In alcuni casi è necessario ricorrere ad altri farmaci che da una parte aumentino il riassorbimento di calcio in sede renale per impedire l’ipercalciuria, quali i diuretici tiazidici, e dall’altra riducano l’assorbimento intestinale di fosfati per evitare l’iperfosfatemia, come il magnesio idrossido + algedrato (Maalox).
Nella condizione sia acuta che cronica una concomitante condizione di ipovitaminosi D dovrebbe essere trattata con colecalciferolo allo scopo di mantenere livelli di 25OH vitamina D ≥ 30 ng/mL per consentire gli effetti pleiotropici di tale ormone.
Nel trattamento dell’ipoparatiroidismo cronico si usano i sali di calcio per os, in aggiunta ad un adeguato apporto alimentare di calcio, che va sempre raccomandato, essendo il calcio alimentare meglio tollerato e meglio assorbito. Fonti alimentari di calcio sono le acque, il latte e i suoi derivati (forniscono più calcio, proteine, magnesio, potassio, zinco, fosforo per calorie rispetto a qualsiasi altro alimento), soia, mandorle, rucola, quinoa, broccoli, semi di chia e di lino). Si utilizzano 800 – 2000 mg/die di calcio elementare in 3-4 dosi. Dopo intenso esercizio fisico è necessario un supplemento di calcio. Il calcio carbonato è il più economico, ha il più elevato contenuto di calcio elementare (40%) ed è presente in compresse da 500 e 1000 mg. Bisogna ricordare che la capacità intestinale di assorbimento di un bolo alimentare di calcio non supera i 500 mg, quindi evitare somministrazioni di compresse di sali di calcio eccedenti i 600 mg, per prevenire sovraccarichi renali. Il calcio carbonato è più tollerato se viene assunto ai pasti e necessita di una normale acidità gastrica per un’efficiente solubilizzazione e assorbimento. La somministrazione di Ca carbonato lontano dal pasto funziona per lo più come chelante del fosforo, non essendo assorbito e, può pertanto essere utilizzato nel controllo dell’iperfosforemia. Sono comuni gli effetti collaterali gastrointestinali (sensazione di peso gastrico), pertanto nei pazienti con acloridria e in terapia con inibitori della pompa protonica, l’assorbimento è ridotto e può essere favorito dall’assunzione di spremute di agrumi.
Il calcio citrato (21%) viene ben assorbito anche a digiuno ed in generale presenta la migliore tollerabilità. Non risente dell’acidità gastrica, quindi è parimenti assorbito se assunto a digiuno o dopo il pasto, in pazienti affetti da acloridria o che assumono inibitori di pompa protonica. E’ più assorbibile nei pazienti sottoposti a by-pass gastrico, condizione in cui il passaggio del duodeno limita la superficie di assorbimento del calcio. L’anione citrato riduce l’effetto litogenico del calcio urinario: la tendenziale riduzione della saturazione dell’ossalato di Ca lo dimostra. L’aumento della escrezione urinaria di citrato compensa l’ipercalciuria, creando un ambiente meno propenso alla formazione di calcoli. Questa azione, che si esplica attraverso l’inibizione della nucleazione e della crescita dei cristalli, oltre ad essere legata alla riduzione della concentrazione ionica del calcio nelle urine, sembra legata ad un effetto diretto del citrato sulla superficie dei cristalli; a tale proposito la letteratura anglosassone ha coniato per gli inibitori il termine di “stone poisons” (veleni dei calcoli) per definire l’importanza degli inibitori in generale e di questo anione in particolare, nel contrastare i processi di formazione, crescita ed aggregazione dei cristalli.
La supplementazione orale di magnesio in condizioni di ipomagnesiemia è mandatoria. Una tipica dose giornaliera di magnesio in pazienti con normale funzionalità renale varia da 240 a 1000 mg in dosi refratte. Un effetto collaterale frequente può essere la diarrea. Se la supplementazione orale di sali di magnesio non è tollerata dal paziente, si può utilizzare l’amiloride, grazie alla sua azione Mg-risparmiatrice renale.
Nella terapia dell’ipoparatiroidismo è indispensabile associare analoghi attivi della vitamina D, sotto forma di calcitriolo (1,25OH2D) o altri analoghi 1-alfa idrossilati come 1-alfacalcidolo, per os alla dose di 0.25 – 2 (0.5-3) µg/die per permettere l’assorbimento intestinale di calcio. Infatti, i composti 1-alfa idrossilati sono gli analoghi della vitamina D più potenti, pur a dosaggi ridotti, raggiungono in breve tempo (3-6 giorni) il massimo effetto, che in altrettanto breve tempo svanisce dopo sospensione della terapia (3-6 giorni). Il ricorso al calcitriolo nell’ipoparatiroidismo è chiaramente correlato all’assenza del PTH che, insieme al frequente riscontro di iperfosforemia, impedisce l’idrossilazione in posizione 1, e quindi l’attivazione, della 25-OH-vitamina D. Titolare verso l’alto la dose di calcitriolo può ridurre la supplementazione orale di calcio. Queste caratteristiche li rendono di più facile e sicuro impiego, con minor rischio di grave tossicità rispetto agli analoghi non idrossilati in posizione 1alfa, quali l’ergocalciferolo, il colecalciferolo, il calcifediolo ed il diidrotachisterolo.
PTH ricombinante
La terapia ormonale sostitutiva con PTH è stata da tempo invocata come potenziale terapia ottimale nel trattamento dell’ipoparatiroidismo poiché l’omeostasi del calcio non è completamente garantita con l’utilizzo solo di calcio e metaboliti attivi della vitamina D.
Il PTH gioca un ruolo centrale nell’omeostasi minerale attraverso il riassorbimento renale di calcio, la promozione dell’escrezione renale di fosfati, la conversione della 25-idrossivitamina D a 1.25- diidrossivitamina D (1-25OH₂D), la forma prontamente attiva. Quest’ultima gioca un ruolo peculiare nel consentire l’assorbimento di calcio e fosforo a livello intestinale. Inoltre, il PTH è un potente regolatore del turnover osseo che nell’ipoparatiroidismo risulta essere soppresso. La terapia convenzionale con Calcio e Vitamina D, pur potendo correggere l’ipocalcemia non è in grado di supplire alle azioni su citate peculiari appunto del PTH. Per questo, in condizioni di grave ipoparatiroidismo nelle quali la terapia convenzionale, pur ad alti dosaggi di supplementazione, non si dimostri in grado di indurre eucalcemia, ma sia piuttosto gravata da ipercalciuria non risolvibile con terapia tiazidica, è necessario valutare un trattamento alternativo.
Con la determina del 27 maggio 2013, l’ente regolatorio nazionale (AIFA) ha autorizzato in Italia l’uso di PTH ricombinante quale terapia sostitutiva ormonale per la cura dell’ipoparatiroidismo cronico grave, inserendo il teriparatide (che utilizza i primi 34 aminoacidi del Paratormone PTH 1-34) nell’elenco dei medicinali erogabili a totale carico, ai sensi della legge 23 dicembre 1996, n° 648. In particolare l’AIFA ha stabilito che possono usufruire della terapia con teriparatide (per un periodo di tempo comunque non superiore ai 36 mesi) pazienti affetti da ipoparatiroidismo cronico grave, di età > 18 anni che nonostante la terapia sostitutiva classica con Calcio e Calcitriolo, non abbiano raggiunto un buon controllo della calcemia sierica, manifestino persistentemente gravi episodi di ipocalcemia e ipomagnesemia ed abbiano sviluppato le complicanze croniche della malattia come formazione di calcoli o la deposizione di calcio a livello del parenchima renale (nefrocalcinosi).
Tale farmaco è stato approvato solo per l’Italia e recenti studi multicentrici italiani hanno dimostrato che la terapia con teriparatide (PTH 1-34) in pazienti ipoparatiroidei post-chirurgici in duplice somministrazione s.c. giornaliera è in grado di ripristinare i normali livelli di calcemia e di ridurre il fabbisogno di supplementazione con Sali di calcio e vitamina D. L’incremento della calcemia avviene rapidamente (già entro i primi 15 giorni) e si mantiene stabile. Contemporaneamente si assiste alla riduzione dei valori di fosforemia. La riduzione dell’apporto farmacologico di calcio e vitamina D permette la progressiva riduzione della calciuria, endpoint peculiare nella protezione dei danni renali indotti dalla terapia convenzionale. Un altro risultato rilevante di questi studi è la dimostrazione, attraverso questionari somministrati ai pazienti trattati, del significativo miglioramento della qualità della vita (QoL), sul piano fisico e mentale.
Analoghi risultati sono stati raggiunti in studi che hanno utilizzato la molecola del Paratormone intatto PTH Intatto 1-84 in monosomministrazione giornaliera nei pazienti ipoparatiroidei. Un recente lavoro che ha valutato i risultati del trattamento con rhPTH 1-84 a sei anni ha dimostrato la riduzione della supplementazione di calcio del 53% e la richiesta di vitamina D del 67%; il 48% dei pazienti ha completamente sospeso la terapia con calcio e vitamina D. Significativo anche il miglioramento della Qualità della vita, indipendentemente dalla calcemia basale o dalle successive modificazioni: tanto più erano bassi i valori di QoL prima della terapia con PTH, tanto maggiori apparivano i miglioramenti indotti dalla terapia con rhPTH 1-84.
Chiaramente l’uso del PTH ricombinante sia esso 1-34 che 1-84 andrà riservato a quei pazienti che avranno dimostrato un declino della qualità della vita, una mancata risoluzione della ipocalcemia sia dal punto di visto clinico che di laboratorio con la terapia convenzionale (calcio e vitamina D) e che mostreranno la comparsa di danni renali. Quindi i pazienti andranno accuratamente selezionati dall’endocrinologo curante.
Mentre la teriparatide può essere prescritta per soli 3 anni e solo in Italia, il PTH 1-84 (Natpar) è stato approvato dall’FDA (Agenzia regolatoria del governo americano) nel 2015 e dall’EMA (Agenzia Europea di Medicina) nel 2017. In Italia si è ancora in attesa di approvazione da parte dell’Agenzia del Farmaco Italiana (AIFA).
Possiamo pertanto affermare che i numerosi lavori pubblicati sui risultati in termine di sicurezza ed efficacia di tali trattamenti, hanno permesso prima e sostengono ora con forza l’indicazione alla terapia con rhPTH 1-84 in pazienti selezionati affetti da ipoparatiroidismo grave, negli USA, in alcuni paesi europei e, si spera, a breve anche in Italia.
Dott.ssa Assunta Santonati
Bibliografia
– Cipriani et al: The Epidemiology of Hypoparathyroidism in Italy: An 8-Year Register-Based Study C Calcif Tissue Int dic. 2017;
– The impact of surgical technique on postoperative hypoparathyroidism in bilateral thyroid surgery. A multivariate analysis of 5846 consecutive patients. Surgery 2003;
– Brandi ML: Genetics of hypoparathyroidism and pseudohypoparathyroidism. J Endocrinol Invest 2011, 34:27-34;
– Levey: a new equation to estimate glomerular filtration rate. Ann Intern Med 2009;
– Brandi et al: Management of Hypoparathyroidism: Summary Statement and Guidelines. JCEM 2016;
– Bollerslev European Society of Endocrinology Clinical Guideline: Treatment of chronichypoparathyroidism in adults. European Journal of Endocrinology 2015
– A Khan and others: Consensus Statement Diagnosis and management of hypoparathyroidism European Journal of Endocrinology European Journal of Endocrinology 2019;
– Newman BD: reversible cardiac dysfunction associated with hypocalcemia: a systematic review and metanalysis of individual patients data. Hearth Fail Rev 2014;
– L.Underbjerg et al: Cardiovascular and Renal Complications to Postsurgical Hypoparathyroidism: A Danish Nationwide Controlled Historic Follow‐Up Study JBMR 2013;
– Underbjerg L. Postsurgical hypoparathyroidism–risk of fractures, psychiatric diseases, cancer, cataract, and infections. J Bone Miner Res. 2014;
– Santonati et al: PTH (1-34) for surgical hypoparathyroidism: a prospective open label investigation of efficacy and quality of life. JCEM 2015;
– Rubin et al: Therapy of hypoparathyroidism with PTH (1-84): a prospective six years investigation of efficacy and safety. JCEM 2016;
– Sikjaer T, et alEffects of PTH (1–84) therapy on muscle function and quality of life in hypoparathyroidism: results from a randomized controlled trial. Osteoporos Int. 2014;
– Mannstadt et al: Safety and Efficacy of 5 Years of Treatment With Recombinant Human Parathyroid Hormone in Adults With Hypoparathyroidism J Clin Endocrinol Metab, November 2019.
– Vokes et al: Recombinant human parathyroid hormone effect on health-related quality of life in adults with chronic hypoparathyroidism 2018;
– SafetyRubin MR et al. Therapy of Hypoparathyroidism With PTH(1-84): A Prospective Six Year Investigation of Efficacy and Safety. JCEM 2016
Share
APR
2020
